À propos des tumeurs desmoïdes
Vue d’ensemble de la maladie
Une maladie infiltrante et agressive1
- Les tumeurs desmoïdes sont des tumeurs localement agressives des tissus mous potentiellement morbides, qui ont tendance à infiltrer les structures environnantes et à se propager le long des parois et des muscles1,2.
- Parfois appelées fibromatose agressive ou fibromatose desmoïde3, ces tumeurs mésenchymateuses peuvent être graves, invalidantes voire, dans de rares cas, entraîner des lésions potentiellement mortelles au niveau des organes2.
- Les tumeurs desmoïdes peuvent infiltrer les tissus adjacents, comprimant ainsi les muscles, les nerfs et les vaisseaux4,5.
Symptomatologie et localisations tumorales
Les tumeurs desmoïdes peuvent entraîner des morbidités sévères et invalidantes2.
- La symptomatologie associée aux tumeurs desmoïdes varie en fonction de la localisation de la tumeur5,6.
- Une étude de cohorte prospective a montré que les tumeurs au niveau de la paroi thoracique, des membres supérieurs, et de la tête et du cou étaient associées à des résultats défavorables suite à une intervention chirurgicale7.
| LOCALISATION DE LA TUMEUR | FRÉQUENCE ESTIMÉE5 | SYMPTÔMES ET COMPLICATIONS FRÉQUENTS |
|---|---|---|
| Intra-abdominale (y compris le mésentère) | 20% | La compression peut entraîner des douleurs, une cachexie, une sensation de malaise, une distension abdominale ou une occlusion des intestins ou de l’uretère5,8 |
| Paroi abdominale | 16% | Les tumeurs de grande taille peuvent provoquer un étirement des tissus, une compression des vaisseaux sanguins et un déplacement de l’intestin ou de la vessie9 |
| Membres inférieurs | 16% | Mobilité réduite, douleur, raideur musculaire ou déformation5,10 |
| Paroi thoracique | 15% | Dyspnée5, dysphagie5, invasion pleurale8, atteinte de la colonne vertébrale11 ou des côtes12, érosion osseuse12 et douleur12 |
| Membres supérieurs | 14% | Mobilité restreinte, atteinte musculaire et ligamentaire, faiblesse des membres, déformation ou douleur5,13 |
| Tête et cou | 8% | Douleur, déficit neurologique, proximité des structures vitales, y compris risque de mortalité lié au resserrement vasculaire ou des voies respiratoires14 |
| Autre | 11% | Symptômes et complications variables selon la localisation5,6 |
La localisation des tumeurs desmoïdes peut avoir un impact considérable sur la qualité de vie15. Par exemple, une tumeur desmoïde présentant des excroissances en « forme de vrille »1 enveloppant les nerfs peut être associée à des douleurs neuropathiques invalidantes5,16.
Évolution de la maladie
Variable et imprévisible1
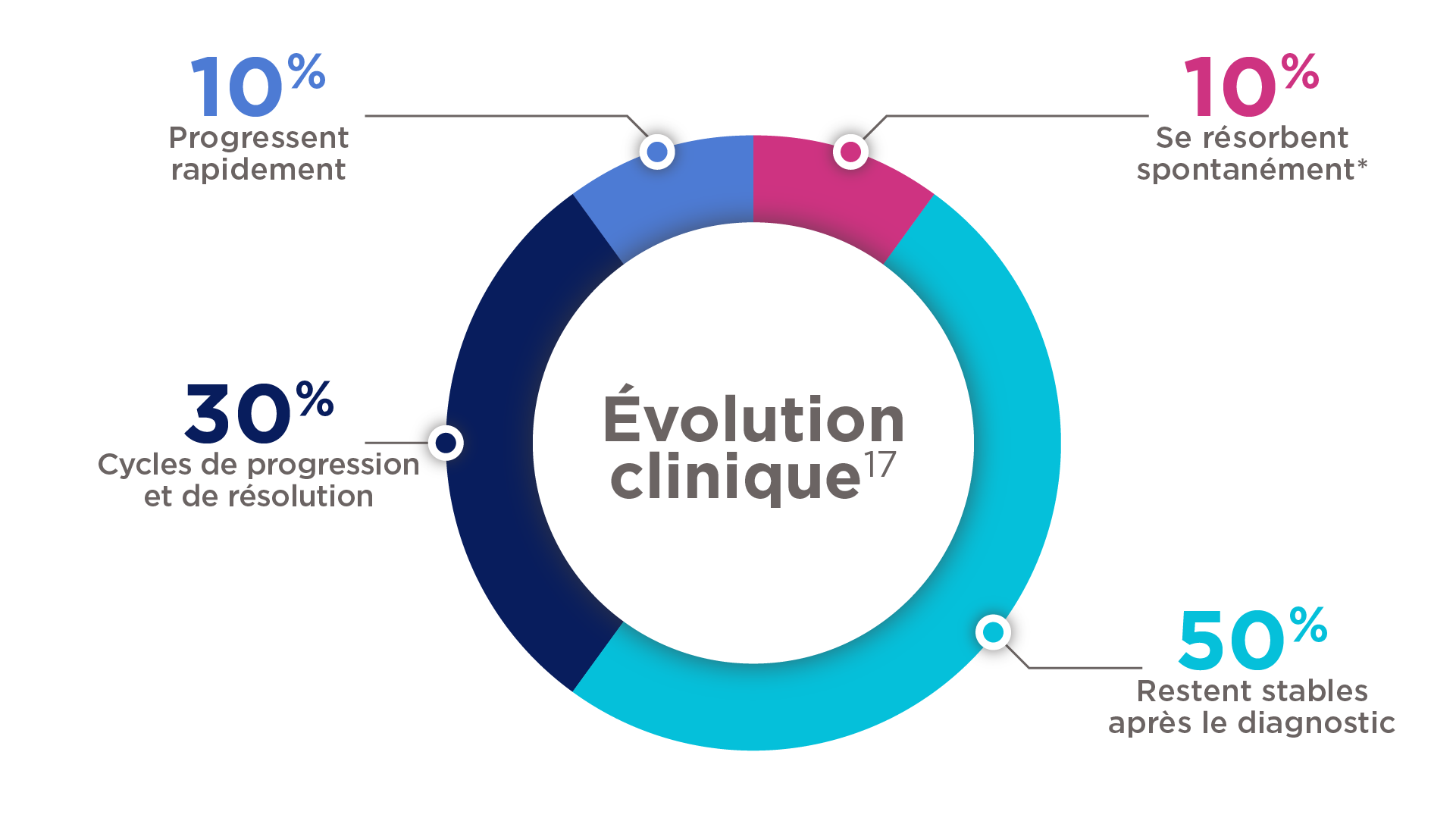
- Les tumeurs desmoïdes se caractérisent par une évolution variable et imprévisible en fonction de la localisation de la tumeur et de la morbidité associée1,5.
- Environ 50 % des tumeurs desmoïdes présentent une biologie agressive, et continuent de croître ou deviennent symptomatiques. La grande majorité des progressions (89 %) sont survenues au cours des deux premières années d’observation4.
Évolution clinique des tumeurs desmoïdes
* 10 à 28 % des tumeurs desmoïdes disparaîtront spontanément sans traitement17.
Incidence et facteurs de risque
Épidémiologie
L’incidence annuelle de la tumeur desmoïde est d’environ 5 cas pour 1 million d’habitants18.
L’Orphanet Report Series indique une incidence annuelle moyenne de trois cas de tumeurs desmoïdes par million de personnes-années en Europe17.
Les études épidémiologiques révèlent que la plupart des cas de tumeurs desmoïdes surviennent chez les personnes âgées de 20 à 44 ans17.
- Les tumeurs desmoïdes sont rares chez les jeunes et les personnes âgées19.
- L’estimation de l’incidence a augmenté ces dernières années, ce qui peut être lié à une amélioration des techniques de diagnostic17.
Patients de sexe féminin
Le ratio femmes/hommes est d’environ 2 à 3 pour 120.
- La grossesse peut favoriser le développement des tumeurs desmoïdes4.
Antécédents de traumatisme
Environ 25 % des patients atteints de tumeurs desmoïdes présentent des antécédents de traumatisme5.
- Une blessure ou une intervention chirurgicale peut augmenter le risque21.
Mutations APC (gène de la polypose adénomateuse coli)
Les caractéristiques phénotypiques sont corrélées à la position de la mutation APC par rapport à certains codons22.
- Les patients atteints de polypose adénomateuse familiale (PAF) présentent un risque 1 000 fois plus élevé de développer des tumeurs desmoïdes par rapport à la population générale20.
Étiologie et pathogenèse des tumeurs desmoïdes
La compréhension de la pathogenèse moléculaire présente un intérêt considérable dans cette maladie en raison de son évolution clinique très variable19.
L’étiologie des tumeurs desmoïdes est inconnue. Cependant, l’identification d’altérations chromosomiques clonales dans une proportion significative des cas confirme la nature néoplasique de ces tumeurs19.
- La pathogenèse des tumeurs desmoïdes serait liée à un traumatisme4.
- L’intervention chirurgicale peut parfois favoriser la croissance de la tumeur4.
- Les facteurs de croissance libérés après une intervention chirurgicale au cours de la phase initiale de cicatrisation pourraient transmettre des signaux qui favorisent l’activation de la β-caténine4.
- La grossesse peut favoriser l’apparition de tumeurs desmoïdes, non seulement en raison d’influences hormonales, mais aussi en raison de la libération systémique de facteurs de croissance4.
- Deux voies ont été impliquées dans la voie canonique Wnt/β-caténine/APC, dans laquelle les mutations CTNNB1 et APC entraînent une accumulation de β-caténine, et la voie Notch, dans laquelle deux clivages surviennent au niveau des récepteurs Notch 17.
- On pense que l’intercommunication potentielle entre les voies Notch et Wnt, ainsi que l’activation de la voie Notch résultant d’une dérégulation de la voie Wnt, sont impliquées dans la pathogenèse des tumeurs desmoïdes17.
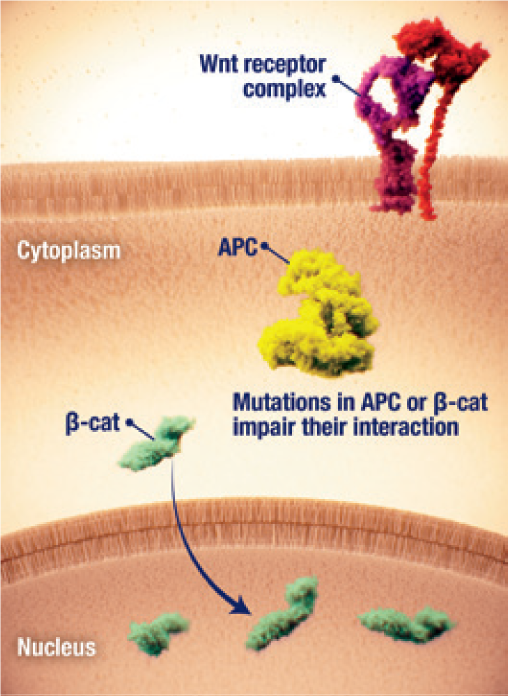
Accumulation nucléaire de β-caténine
- On a pu observer que la dérégulation de la voie Wnt/β-caténine était impliquée dans la pathogenèse des tumeurs desmoïdes2,23.
- L’accumulation nucléaire de β-caténine et la transcription du gène en aval constitue un facteur clé de la prolifération des cellules de tumeurs desmoïdes2,24.
- L’accumulation nucléaire de β-caténine peut être provoquée par2,24 :
- des mutations activatrices du gène de la β-caténine CTNNB1
- des mutations inactivantes du régulateur négatif APC, souvent liées aux cas de polypose adénomateuse familiale (PAF)
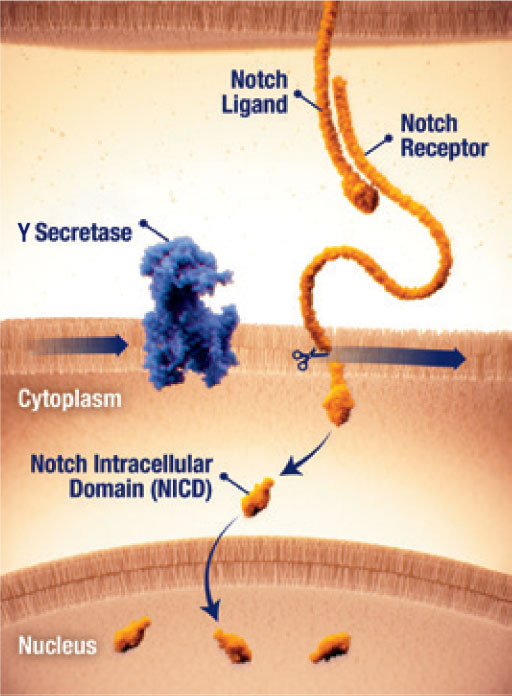
L’activation de Notch par la γ-sécrétase
- La voie Notch peut être active dans les tumeurs desmoïdes25.
- Lorsqu’elle est dérégulée, la voie Notch peut activer d’autres voies qui contribuent à la croissance tumorale25.
- La signalisation du récepteur Notch nécessite une activation protéolytique par l’enzyme γ-sécrétase (gamma sécrétase)25.
- Le clivage de la γ-sécrétase libère le domaine intracellulaire Notch (Notch intracellular domain, NICD), qui se déplace vers le noyau et active la transcription génique25.
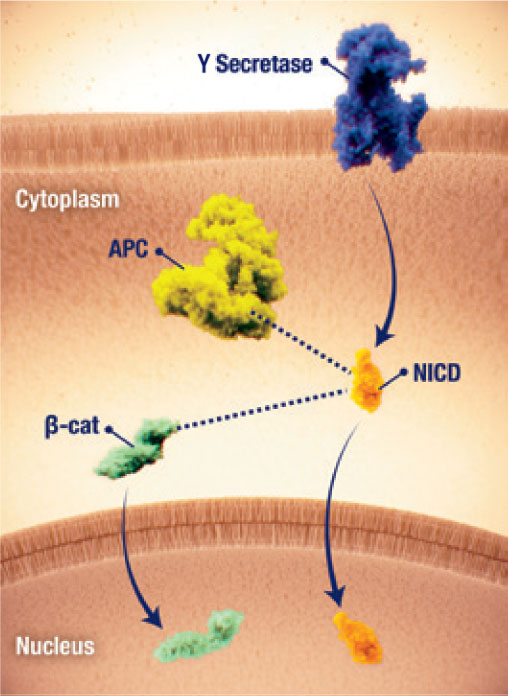
Intercommunications des voies
- Il est possible que les intercommunications entre les voies Wnt/β-caténine et Notch contribuent à la pathogenèse des tumeurs desmoïdes17.
Risque de récidive
- Les taux de récidive peuvent être influencés par la localisation de la tumeur17 :
- Les tumeurs au niveau des extrémités sont localement agressives et présentent des taux de récidive allant de 24 % à 77 %.
- Les taux de récidive locale des tumeurs intra-abdominales chez les patients atteints de PAF sont plus élevés que ceux des tumeurs extra-abdominales, et seraient compris entre 57 % et 86 %.
Il existe un risque élevé de récidive locale suite à une intervention chirurgicale17
- Les taux de récidive peuvent être exacerbés par des traumatismes, comme les traumatismes liés à une intervention chirurgicale, et varient d’environ 25% a 60% en 5 ans17.
- L’invasion des vaisseaux et des nerfs principaux, ainsi que la qualité des marges chirurgicales sont des facteurs clés du taux élevé de récidive postopératoire26.
- Malheureusement, même lorsque les marges chirurgicales sont exemptes de tumeur, les taux de récidive sont élevés27.
Les facteurs de croissance libérés au cours de la phase initiale de cicatrisation postopératoire pourraient favoriser l’activation de la β-caténine4.
- Le fait que certaines tumeurs aient récidivé après une intervention chirurgicale, mais se soient ensuite stabilisées sans traitement, suggère que les facteurs de croissance libérés après l’intervention chirurgicale pourraient avoir favorisé la récidive de tumeurs qui seraient par ailleurs restées indolentes4.
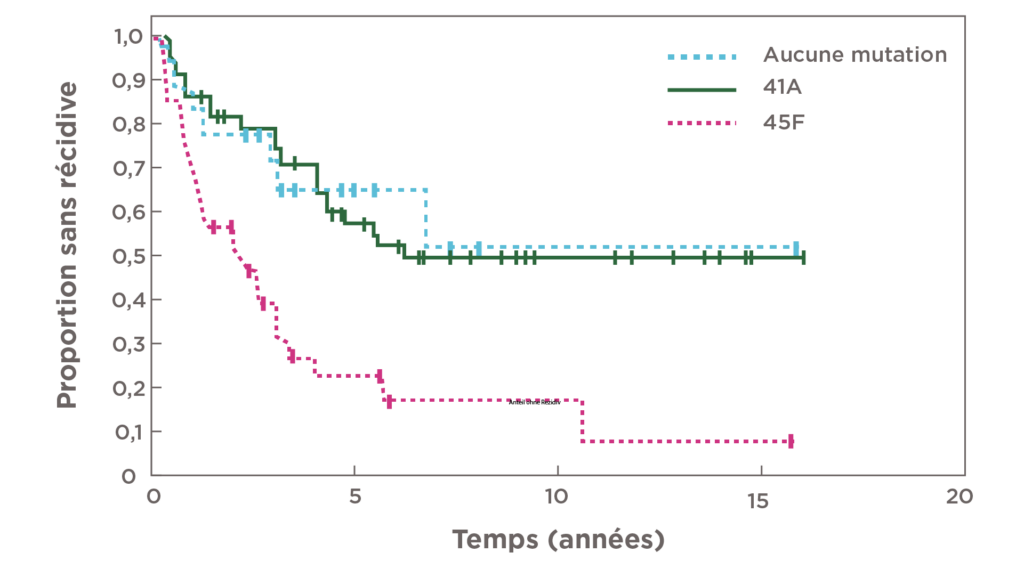
- La mutation spécifique S45F du gène CTNNB1 semble être associée à une survie sans récidive moins bonne après une intervention chirurgicale28.
- La survie sans récidive à 5 ans était significativement plus faible chez les patients atteints de tumeurs desmoïdes avec mutation S45F (P< 0,0001) par rapport aux patients atteints de tumeurs avec mutation T41A ou ne présentant pas de mutation29.
| MUTATION | SURVIE SANS RÉCIDIVE ESTIMÉE (IC À 95 %) |
|---|---|
| 45F | 23% (10%-40%) |
| 41A | 57% (43%-69%) |
| CTNNB1 non muté | 65% (38%-83%) |
Les patients présentant des mutations CTNNB1 au niveau du codon 45 (45F) ont un risque de récidive postopératoire 3 fois plus élevé29
Dans le cadre d’une méta-analyse, la taille de la tumeur a été identifiée comme un médiateur important dans l’augmentation du risque de récidive chez les patients porteurs de la mutation CTNNB1 S45F30.
Principes de prise en charge
Il est impératif de choisir avec soin la stratégie de prise en charge de chaque patient atteint de tumeurs desmoïdes afin d'optimiser le contrôle des tumeurs et d'améliorer la qualité de vie18.
Des efforts importants visant à rationaliser la prise en charge de cette maladie ont été entrepris au cours des dix dernières années18.
Actuellement, les besoins non satisfaits dans le cadre des tumeurs desmoïdes incluent un diagnostic précoce et précis et des traitements approuvés indiqués pour les patients atteints de tumeurs desmoïdes17.
Dans une étude menée au Memorial Sloan Kettering Cancer Center, 58 % des patients atteints de tumeurs desmoïdes sont passés d’une surveillance active au traitement de première intention sans progression de la tumeur sur le plan radiographique31†.
Les objectifs du traitement ne doivent pas se concentrer uniquement sur des marqueurs cliniques, tels que la survie sans progression, mais également prendre en compte des critères d’évaluation pertinents pour le patient, comme la réduction du fardeau symptomatique spécifique des tumeurs desmoïdes (par ex., la douleur) et leur impact sur la vie des patients, l’amélioration de leurs capacités pour effectuer les activités quotidiennes et leur qualité de vie globale17.
Identification précoce de la progression
L’identification de la progression d’une tumeur desmoïde peut permettre l’instauration plus précoce d’un traitement approprié.
- Pour améliorer les résultats des patients, les professionnels de santé devraient évaluer la progression le plus tôt possible avec au moins l’un des éléments suivants :
- La douleur peut être un indicateur pronostique de progression34 et peut être associée à de moins bons résultats35.
- Le risque de progression peut être plus élevé pour les plus grosses tumeurs3,33.
† Les patients atteints de tumeurs desmoïdes primaires ou récidivantes (n = 160) ont été identifiés rétrospectivement à partir d’une base de données institutionnelle. Parmi les patients en observation initiale pour lesquels des séries d’examens d’IRM étaient disponibles, 14 sur 24 (58 %) ayant reçu un traitement actif n’ont pas présenté de croissance tumorale selon les critères RECIST31. Élaboré à partir du texte, référence 31.
Écoutez le point de vue d’un oncologue médical sur les tumeurs desmoïdes
Comprendre les tumeurs desmoïdes
Regardez la vidéo du Dr Riedel, oncologue médical au Duke Health et Duke Cancer Institute, dans laquelle il donne une vue d’ensemble sur les tumeurs desmoïdes, y compris en matière de physiopathologie, de présentations cliniques et d’impact sur les patients.
APC, gène de l’adénomatose polypose coli ; TDM, tomodensitométrie ; CTNNB1, gène de la caténine β1 ; PAF, polypose adénomateuse familiale ; IRM, imagerie par résonance magnétique ; NICD, domaine intracellulaire Notch ; RECIST, Response Evaluation Criteria In Solid Tumors (critères d’évaluation de la réponse dans les tumeurs solides) ; S45F, type de mutation ; T41A, type de mutation ; Wnt, site d’intégration lié à Wingless.
Références
- Kasper B et al. Desmoid Working Group. An update on the management of sporadic desmoid-type fibromatosis: a European Consensus Initiative between Sarcoma Patients EuroNet (SPAEN) and European Organization for Research and Treatment of Cancer (EORTC)/Soft Tissue and Bone Sarcoma Group (STBSG). Ann Oncol. 2017;28(10):2399-2408.
- Penel N et al. Adult desmoid tumors: biology, management and ongoing trials. Curr Opin Oncol. 2017;29(4):268-274.
- Gronchi A et al. Desmoid tumor working group. The management of desmoid tumours: a joint global consensus-based guideline approach for adult and paediatric patients. Eur J Cancer. 2020;127:96-107.
- Bonvalot S et al. The treatment of desmoid tumors: a stepwise clinical approach. Ann Oncol. 2012;23(suppl 10):x158-x166.
- Constantinidou A et al. Clinical presentation of desmoid tumors. In: Litchman C, ed. Desmoid Tumors. Springer; 2012:chap 2. Consulté le 9 avril 2024. https://www.researchgate.net/publication/226455135.
- Joglekar SB et al. Current perspectives on desmoid tumors: the mayo clinic approach. Cancers (Basel). 2011;3(3):3143-3155.
- Penel N et al. Surgical versus non-surgical approach in primary desmoid-type fibromatosis patients: a nationwide prospective cohort from the French Sarcoma Group. Eur J Cancer. 2017;83:125-131.
- Shinagare AB et al. A to Z of desmoid tumors. AJR Am J Roentgenol. 2011;197(6):W1008-W1014.
- Koshariya M et al. Giant desmoid tumor of the anterior abdominal wall in a young female: a case report. Case Rep Surg. 2013;2013:780862.
- McDonald ES et al. Best cases from the AFIP: extraabdominal desmoid-type fibromatosis. Radiographics. 2008;28(3):901-906.
- Abrão FC et al. Desmoid tumors of the chest wall: surgical challenges and possible risk factors. Clinics (Sao Paulo). 2011;66(4):705-708.
- Xie Y et al. Recurrent desmoid tumor of the mediastinum: a case report. Oncol Lett. 2014;8(5):2276-2278.
- Scaramussa FS et al. Desmoid tumor in hand: a case report. SM J Orthop. 2016;2(3):1036.
- Baranov E et al. Soft tissue special issue: fibroblastic and myofibroblastic neoplasms of the head and neck. Head Neck Pathol. 2020;14(1):43-58.
- Ingley KM et al. High prevalence of persistent emotional distress in desmoid tumor. Psychooncology. 2020;29(2):311-320.
- Gounder MM et al. Prospective development of a patient-reported outcomes instrument for desmoid tumors or aggressive fibromatosis. Cancer. 2020;126(3):531-539.
- Bektas M et al. Desmoid tumors: a comprehensive review. Adv Ther. 2023;40(9):3697-3722.
- Kasper B et al. Desmoid Tumor Working Group. Current management of desmoid tumors: a review. JAMA Oncol. 2024;10(8):1121-1128.
- Ravi V et al. Desmoid tumors: epidemiology, molecular pathogenesis, clinical presentation, diagnosis, and local therapy Jun 2024 UptoDate.
- Skubitz KM. Biology and treatment of aggressive fibromatosis or desmoid tumor. Mayo Clin Proc. 2017;92(6):947-964.
- Lopez R et al. Problems in diagnosis and management of desmoid tumors. Am J Surg. 1990;159(5):450-453.
- Kasper B et al. Desmoid tumors: clinical features and treatment options for advanced disease. Oncologist. 2011;16(5):682-93.
- Crago AM et al. Near universal detection of alterations in CTNNB1 and Wnt pathway regulators in desmoid-type fi bromatosis by whole-exome sequencing and genomic analysis. Genes Chromosomes Cancer. 2015;54(10):606-615.
- Gronchi A et al. Desmoid tumor working group. The management of desmoid tumours: a joint global consensus-based guideline approach for adult and paediatric patients [supplementary appendix]. Eur J Cancer. 2020;127:96-107.
- Shang H et al. Targeting the Notch pathway: a potential therapeutic approach for desmoid tumors. Cancer. 2015;121(22):4088-4096.
- Wang YF et al. Postoperative recurrence of desmoid tumors: clinical and pathological perspectives. World J Surg Oncol. 2015;13:26.
- Easter DW et al. Recent trends in the management of desmoid tumors. Summary of 19 cases and review of the literature. Ann Surg. 1989;210(6):765-769.
- Napolitano A et al. Recent advances in desmoid tumor therapy. Cancers (Basel). 2020;12(8):2135.
- Lazar AJ et al. Specific mutations in the beta-catenin gene (CTNNB1) correlate with local recurrence in sporadic desmoid tumors. Am J Pathol. 2008;173(5):1518-27.
- Timbergen MJM et al. The prognostic role of β-Catenin mutations in desmoid-type fibromatosis undergoing resection only: a meta-analysis of individual patient data. Ann Surg. 2021;273(6):1094-1101.
- Cassidy MR et al. Association of MRI T2 signal intensity with desmoid tumor progression during active observation: a retrospective cohort study. Ann Surg. 2020;271(4):748-755.
- Référencé avec l’autorisation des lignes directrices en matière de pratique clinique en oncologie du NCCN (lignes directrices du NCCN®) pour le sarcome des tissus mous V.1.2024. © National Comprehensive Cancer Network, Inc. 2024. Tous droits réservés. Consulté le 29 avril 2024. Pour consulter la dernière version complète des lignes directrices, rendez-vous en ligne sur NCCN.org. Le NCCN n’offre aucune garantie de quelque sorte, que ce soit concernant leur contenu, leur utilisation ou leur application et décline toute responsabilité quant à leur quelconque application ou utilisation.
- Kasper B et al. Desmoid Tumor Working Group. Current management of desmoid tumors: a review. [supplementary appendix] JAMA Oncol. 2024;10(8):1121-1128.
- Cuomo P et al. Extra-abdominal desmoid tumor fibromatosis: a multicenter EMSOS study. BMC Cancer. 2021;21(1):437.
- Penel N et al. Pain in desmoid-type fibromatosis: prevalence, determinants and prognosis value. Int J Cancer. 2023;153(2):407-416.